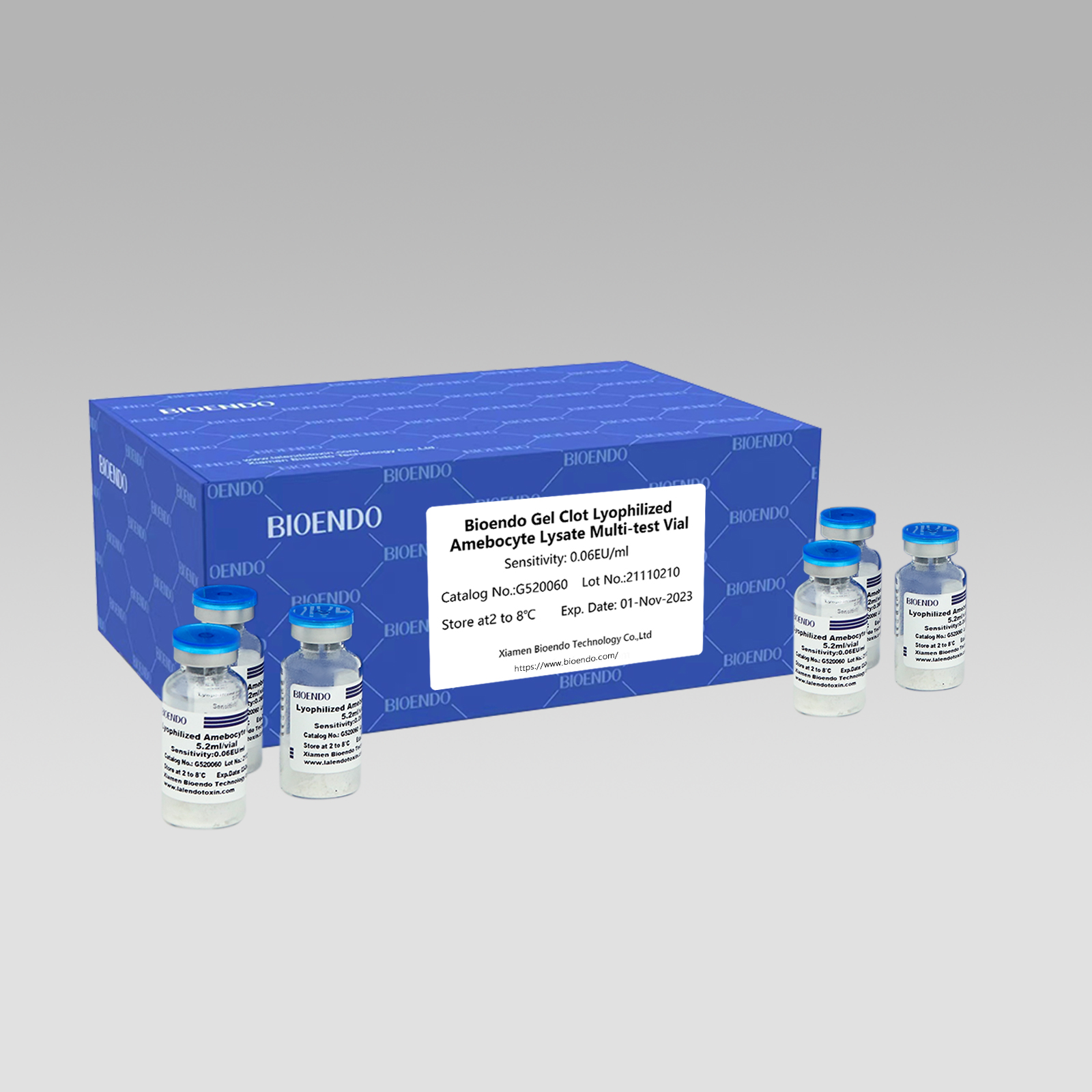
Gel Clot Lyophilized Amebocyte Lysate Multi-test Vial G52
Ang serye ng Bioendo G52 ay pangunahing ginagamit sa operasyon ng eksperimento ngpagsusuri ng bacterial endotoxinbilang pamamaraan ng Bioassay.
1. Impormasyon ng Produkto
Gel Clot method Ang Lyophilized Amebocyte Lysate Multi-test Vial ay ang Lyophilized Amebocyte Lysate reagent na pumipili at gumagamit ng gel clot technique para makita ang endotoxin o pyrogen.
Bilang malawakang pamamaraan, ang gel-clot test para sa endotoxin ay simple at hindi nangangailangan ng tiyak at mamahaling instrumento.Nagbibigay ang Bioendo ng Gel Clot Lyophilized Amebocyte Lysate - LAL reagent sa 5.2ml bawat vial.
2. Mga Parameter ng Produkto
Saklaw ng pagiging sensitibo: 0.03EU/ml, 0.06EU/ml, 0.125EU/ml, 0.25EU/ml, 0.5 EU/ml
3. Application ng Produkto
End-product endotoxin (pyrogen) kwalipikasyon, tubig para sa iniksyonpagsusuri ng endotoxin, hilaw na materyalpagsusuri ng endotoxino pagsubaybay sa antas ng endotoxin sa panahon ng proseso ng pagmamanupaktura para sa mga kumpanya ng parmasyutiko o mga tagagawa ng mga medikal na kagamitan.
Tandaan:
Ang Lyophilized Amebocyte Lysate (LAL reagent) na ginawa ng Bioendo ay ginawa mula sa lysate ng amebocytes (white blood cells) mula sa horseshoe crab.
Ang natatanging reagent na ito ay naging isang mahalagang kasangkapan sa industriya ng parmasyutiko at medikal na aparato para sa pagtuklas ng mga bacterial endotoxin.Ang mga amebocyte ng horseshoe crab ay naglalaman ng substance na tinatawag na Lyophilized Amebocyte Lysate, na tumutugon sa bacterial endotoxin sa pamamagitan ng pagbuo ng parang gel na namuong dugo.Ang reaksyong ito ay ang batayan para sa pagsusuri sa LAL, na ginagamit upang matiyak ang kaligtasan ng mga medikal na kagamitan, gamot, at iba pang mga produkto na nakikipag-ugnayan sa katawan ng tao.
Ang paggamit ng LAL reagent ay nagbago ng proseso ngpagtuklas ng endotoxinsa medikal na larangan kaysa sa Rabit test assay.Ang walang kapantay na sensitivity at specificity nito ay ginagawa itong mahalagang bahagi sa kontrol ng kalidad at pagtitiyak sa kaligtasan ng mga parmasyutiko, biologic, at mga medikal na device.Ang pagsusulit ng LAL ay isang mabilis at maaasahang paraan para sapagtuklas ng endotoxin, na nagbibigay ng mga resulta sa kasing liit ng 60 minuto.Ang kahusayan na ito ay nagbibigay-daan para sa mabilis at tumpak na mga desisyon tungkol sa pagpapalabas ng mga produkto, sa huli ay nagpapahusay sa pangkalahatang kaligtasan at bisa ng mga medikal na paggamot at mga device.
Ang Lyophilized Amebocyte Lysate (LAL reagent) ng Bioendo ay ginawa sa ilalim ng mahigpit na pamantayan ng kalidad upang matiyak ang pagiging epektibo at pagiging maaasahan nito.Nakatuon ang kumpanya sa paggamit ng mga napapanatiling kasanayan sa pag-aani ng mga horseshoe crab para mabawasan ang anumang negatibong epekto sa kanilang populasyon.Sa pamamagitan ng pagbibigay-priyoridad sa kapakanan ng mga nilalang na ito, tinitiyak ng Bioendo ang patuloy na supply ng mahalagang mapagkukunang ito para sa paggawa ng mga LAL reagents.Bukod pa rito, ang mga patuloy na pagsisikap sa pananaliksik at pagpapaunlad ay nakatuon sa pagpapabuti ng pagganap at kakayahang magamit ngSinusuri ng LAL ang endotoxin, higit pang isulong ang kanilang utility sa industriyang medikal at parmasyutiko.
Paraan ng gel clotPagsusuri ng LAL, ang reconstituted lysate reagent ay nakakakuha ng hindi bababa sa 50 na pagsusuri sa bawat vial:
| Numero ng Catalog | Sensitivity (EU/ml o IU/ml) | ml/vial | Mga Pagsubok/Vial | Mga vial/pack |
| G520030 | 0.03 | 5.2 | 50 | 10 |
| G520060 | 0.06 | 5.2 | 50 | 10 |
| G520125 | 0.125 | 5.2 | 50 | 10 |
| G520250 | 0.25 | 5.2 | 50 | 10 |
| G520500 | 0.5 | 5.2 | 50 | 10 |
Kondisyon ng produkto:
Ang Lyophilized Amebocyte Lysate - LAL reagent sensitivity at ang Control Standard Endotoxin potency ay sinusuri laban sa USP Reference Standard Endotoxin.Ang mga Lyophilized Amebocyte reagent kit ay may kasamang pagtuturo ng produkto, Sertipiko ng Pagsusuri, MSDS.
Ano ang pagkakaiba sa pagitan ng Bioendo single test vial at multiple test vial?
● Single test: buuin muli ang singlepagsubok sa limulus lysateo tinawaglimulus amebocytesa pamamagitan ng BET na tubig sa glass vial o glass ampoule.
● Multi-test: buuin muli ang lysate reagent ng BET na tubig, at pagkatapos ay magdagdag ng markadong dami ng lysate reagent kasunod ng COA sa reaction tube o well plate para magamit.Walang pagkakaiba sa sample pre-processing procedure;ayon sa dami ng pagsubok na ginamit, ang laki ng sample na ginamit para sa isang pagsubok ay mas malaki kaysa sa sukat ng sample na ginamit para sa maraming pagsubok.
Bakit espesyal ang gel clot assay kit G52 para sa dami ng mass sample?
1. Multi test LAL reagent para sa endotoxin detection sa mga aplikasyon ng mass samples' LAL assay operation procedures.
2. G52 serye ng Gel clot endotoxin assay multi test glass vial hindi na kailangan ng sopistikadong microplate reader.Sa LAL assay ang pamamaraan ng pagpapapisa ng tubig sa pamamagitan ng paliguan ng tubig o dry heat incubator ay maginhawang aparato.
3. Mataas na kalidad ng endotoxin free tube (<0.005EU/ml) at Mataas na kalidad ng pyrogen free tips (<0.005EU/ml) bilang mga garantisadong consumable upang matiyak ang tamang resulta.
4. Para pumili ng Bioendo single LAL test vial o multi LAL test vial ayon sa dami ng sample, ang target ayPagsusuri ng LAL para sa mga pyrogenpagtuklas.
Mga kaugnay na produkto sa endotoxin test assay:
Tubig para sa Bacterial Endotoxins Test (BET), Inirerekomenda ang TRW50 o TRW100
Endotoxin free glass tube ( dilution tube ), Inirerekomenda ang T1310018 at T107540
Mga tip sa libreng pyrogen, Irekomenda ang PT25096 o PT100096
Pipettor, Inirerekomenda ang PSB0220
Lagayan ng test tube
Incubator ng Incubator (Water Bath o Dry Heat Incubator ), para irekomenda ang Bioendo Dry Heat Incubator TAL-M2 ay 60 butas isang modular.
Vortex Mixter, Inirerekomenda ang VXH.
Control Standard Endotoxin, CSE10V.